Por: Pedro Henrique dos Santos Souza Teixeira
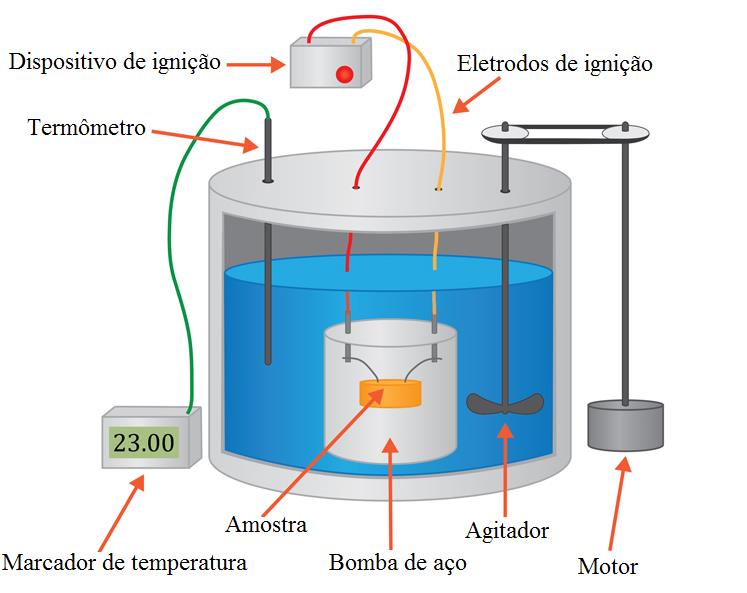
Um calorímetro é um equipamento empregado na medição do valor calórico dos alimentos. Um calorímetro consiste em um recipiente isolado, geralmente feito de aço inoxidável, chamado bomba calorimétrica. O recipiente contém uma amostra conhecida de um alimento a ser queimado, e por ser um sistema isolado segue a 1ª Lei da Termodinâmica, o princípio da conservação de energia.
Para determinar o valor calórico dos alimentos é realizada sua combustão em condições controladas e analisada a transferência de calor gerada por tal processo, através de um calorímetro de água auxiliar, medindo a quantidade de calor transferida para a água. O valor calórico do alimento é adquirido/calculado por meio desta quantidade de calor liberada durante a combustão.
É importante analisar as condições em que ocorre a queima dos alimentos, visto que tanto o volume quanto a pressão podem ou não ser constantes durante o processo, e irão impactar o resultado final de diferentes maneiras.
No calorímetro de volume fixo, o alimento é queimado em um recipiente fechado, evitando a troca de substâncias com o meio. Em um calorímetro de pressão constante, o alimento é queimado em um recipiente no qual substâncias, incluindo gases, são trocadas com o ambiente. Neste caso, a combustão completa do alimento provoca uma alteração na pressão do sistema, medida por meio de um manômetro ou outro instrumento.
Os calorímetros medem as mudanças de pressão e usam essa informação para determinar a quantidade de energia liberada durante a combustão. Portanto, o método utilizado pelo calorímetro afetará a forma como ele mede e calcula a energia liberada durante o processo de combustão. A escolha do tipo de calorímetro depende da natureza do alimento e da finalidade da análise. Tal diferença ainda pode ser analisada matematicamente, através da capacidade calorífica (ou capacidade térmica) das substâncias, que terá valores diferentes quando o calor é liberado pelo sistema a pressão constante ou a volume constante, representada por: Cv (volume constante) e Cp (pressão constante), que podem ser calculados conforme as equações a seguir:
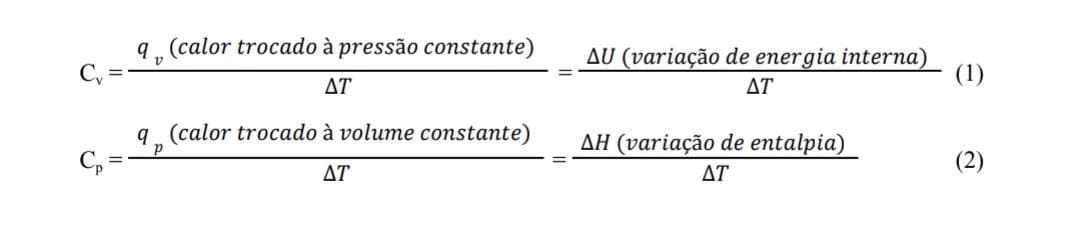
A capacidade térmica (C) de uma substância, propriedade extensiva, representa o valor de energia térmica armazenada na substância e pode ser encarada como a quantidade de calor que deve ser fornecido a uma substância para que ocorra a variação de sua temperatura, geralmente medida em cal/°C ou J/K. A diferença existente entre as duas capacidades é mais relevante em processos que envolvam gases pois, para aqueles que ocorrem em solução aquosa ou entre sólidos (não envolvendo gases) não há variações significativas de volume, e Cv ≈ Cp.
Os calorímetros que utilizam volume constante tendem a fornecer medições mais precisas pois evitam a perda de energia por meio de trabalho mecânico. Isso permite que a energia liberada pela reação seja totalmente transferida para o sistema, permitindo uma medição mais precisa do poder calorífico. A possível troca de matéria que ocorre nos calorímetros de pressão constante acaba por resultar em perdas de energia na forma de trabalho mecânico, deixando a medição do valor calórico menos precisa.
Em suma, a escolha na utilização do tipo de calorímetro poderá influenciar diretamente os resultados obtidos para a determinação do valor calórico do alimento ou outra substância, mas tais diferenças podem ser mínimas a depender do calorímetro ou da substância. Existem ainda outras formas de determinar o valor calórico dos alimentos além da calorimetria direta (utilizando um calorímetro), entre elas temos: métodos indiretos, análise proximal e equações de estimativa, que podem ser utilizados em casos mais específicos, a depender do objetivo da medição.
Referências:
NISENBAUM, Moisés André; MEDINA, Márcio Nasser. A Primeira Lei da Termodinâmica. Disponível em:<A_primeira_lei_termodinamica-libre.pdf (d1wqtxts1xzle7.cloudfront.net)> . Acesso em: 20 mai 2023.
MATTOS, Cristiano; GASPAR, Alberto. Uma medida de calor específico sem calorímetro. Revista Brasileira de Ensino de Física, v. 25, p. 45-48, 2003. Disponível em: https://www.scielo.br/j/rbef/a/bc4SfgnsvkWVv5QdhVbSbtk/?lang=pt. Acesso em: 20 mai 2023.
PEREIRA, José Augusto. “INTRODUÇÃO À CALORIMETRIA. Determinação da entalpia de formação padrão do cloreto de amónio sólido.” Instituto de Ciências Biomédicas de Abel Salazar – UP, 2009. Disponível em:https://repositorio-aberto.up.pt/bitstream/10216/72422/2/44625.pdf . Acesso em: 20 mai 2023.
CASTELLAN, Gilbert. Fundamentos de Físico-Química – 1ª ed. LTC, 1986 DA ROCHA, Fábio Saraiva; GUADAGNINI, Paulo Henrique; LUCCHESE, Marcia Maria. Projeto de um calorímetro de relaxação para ensino de Física. Caderno Brasileiro de Ensino de Física, v. 34, n. 1, p. 278-297, 2017